2025年10月13日,课题组在《美国化学会志》(Journal of the American Chemical Society)期刊发表了题为“Synergistic Programming of Macrophages by Hybrid Glycocalyx-Inspired Nanoparticles for Adoptive Cell Therapy”的研究论文,通讯作者为陈国颂教授和李龙助理教授。
天然糖萼作为细胞表面的关键多糖结构,在细胞识别与免疫应答中具有重要作用。受此启发,研究人员开发了糖聚合物用于模拟糖萼的功能。这类结构不仅能高效呈递糖链,还具有良好的生物相容性、生物识别能力与免疫调控潜力。然而,在免疫应用中糖聚合物仍面临两大挑战。其一是寡糖合成与聚合技术的结合尚未得到充分探索,限制了其与相应受体蛋白的结合效能。其二是糖聚合物易被内吞降解,且缺乏有效的胞内协同刺激,导致其激活的免疫反应难以持久——这一局限在细胞表型易受微环境影响的免疫细胞中尤为突出。
基于此,本工作模拟天然甘露聚糖,通过结合复杂糖苷合成和可控聚合,合成了单甘露糖苷和二甘露糖苷修饰的两亲性糖聚合物,其在水溶液中可自组装成纳米颗粒。以细胞表型高度可塑的巨噬细胞作为模型,检测了糖萼模拟纳米颗粒的免疫激活功能。实验结果表明糖萼模拟纳米颗粒可以有效地将原代的巨噬细胞(MØ)编程为促炎的M1样巨噬细胞(M1 MØ)。为了产生持久的免疫激活,从而使得M1 MØ可以抵抗免疫抑制性的微环境,进一步将具有胞内激活能力的氧化铁纳米粒子与糖聚合物进行了共组装,制备了杂化的糖萼模拟纳米颗粒。其中糖聚合物不仅具有胞外的免疫刺激效果,还可以通过受体介导的细胞内吞促进氧化铁进入胞内,解决了其单独使用时细胞内化不足的问题。在胞外和胞内的双重协同信号刺激下,编程后的MØ能够抵抗免疫抑制微环境,长时间维持在促炎状态。同时体外试验表明,与单甘露糖苷相比,二甘露糖苷修饰的纳米颗粒与细胞表面受体的亲和力更高,能更有效地促进氧化铁的内化,对巨噬细胞的促炎性极化效果也更优。进一步,在荷瘤小鼠模型上,利用编程后的M1 MØ进行了过继转移细胞治疗。体内实验结果显示,过继性转移杂化糖萼模拟纳米颗粒编程的M1 MØ,不仅能有效抑制肿瘤生长,还能够改善肿瘤的免疫微环境,增加杀伤性T细胞的浸润,从而激活更广泛的抗肿瘤免疫应答。
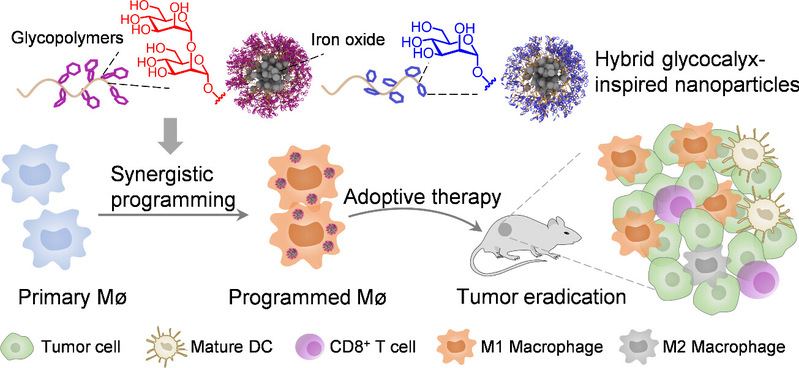
图1. 杂化的糖萼模拟纳米粒子编程巨噬细胞用于过继性细胞疗法
该工作在不使用生物源性物质的情况下,利用全合成的人工糖萼结构作为免疫刺激剂,成功重塑了用于过继性治疗的巨噬细胞功能,凸显了合成糖聚合物在精准调控免疫细胞行为方面的巨大潜力,为癌症免疫治疗乃至其他生物材料和纳米医学应用开辟了一条崭新的途径。
论文链接:
https://doi.org/10.1021/jacs.5c14740
